Il Trattamento delle Infezioni di Protesi Ortopedica: luci ed ombre
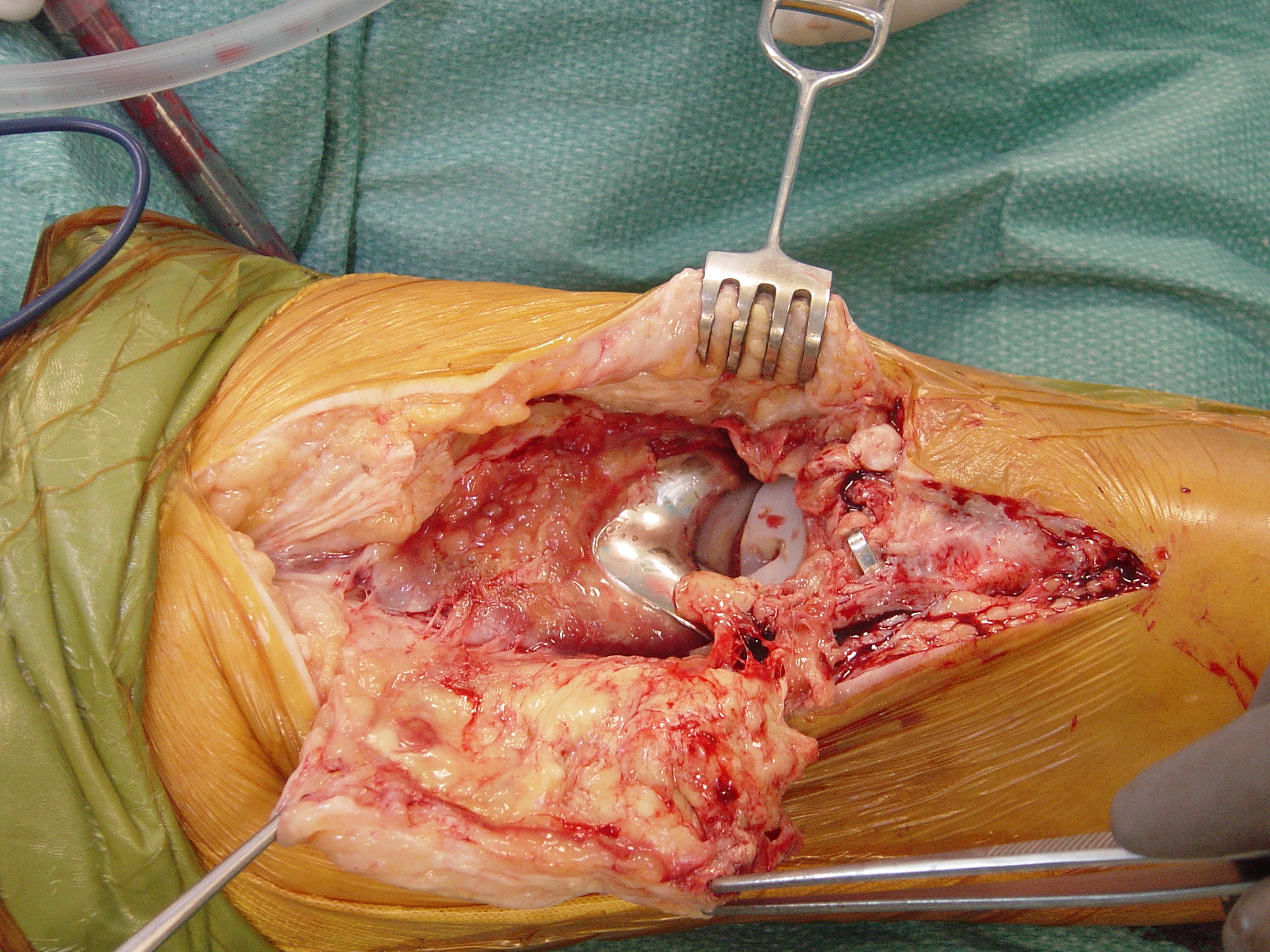
La letteratura scientifica riguardo le infezioni osteoarticolari è storicamente povera, lacunosa e, nella grande maggioranza dei casi, di modesto livello. Storicamente è estremamente difficile ritrovarvi studi controllati e vi abbondano descrizioni di casistiche , spesso eterogenee e numericamente insufficienti.
Tale difficoltà a disegnare studi validi riconosce svariati motivi clinici e metodologici (eterogenicità delle situazioni cliniche, difficoltà del trattamento, lunghezza dei trattamenti e necessità di follow up particolarmente prolungati) ma è principalmente legata, a mio avviso, ad una variabile di fondamentale importanza costituita dall’approccio chirurgico che è, per definizione, fortemente operatore-dipendente e quindi mal si presta a studi clinici rigorosi e confrontabili.
Solo nell’ultimo decennio si è assistito ad un progressivo miglioramento della qualità dei dati disponibili e limitatamente ad alcune patologie. Le infezioni protesiche (PJI) sono certamente, tra queste, quelle che hanno concentrato di più l’attenzione di numerosi e qualificati gruppi di ricerca sia per la maggiore riproducibilità dei dati in questo campo, sia per l’enorme impatto in termini di salute e costi che le PJI comportano.
Se nel corso dei decenni si è infatti enormemente ridotta l’incidenza di complicanze infettive nella chirurgia protesica, assestatasi ormai su valori di 1,7% per gli impianti primari di anca e di 2,5% per quelli di ginocchio (1), il loro numero assoluto è, in tutti i paesi occidentali, in rapida e costante crescita. Il numero di impianti protesici di anca e ginocchio nel 2006 è stato, nei soli Stati Uniti di 800.000. (2). Entro il 2030 è prevista una crescita di tali tipologie di interventi pari al 174% per l’anca e 673% per il ginocchio (3). L’impatto sulla salute pubblica in termini di mortalità (valutata tra 1 e 3%), morbilità e costi economici è destinata ad essere pesantissima. Il costo economico delle PJI, in particolare, risulta assai elevato e destinato a salire in caso di trattamenti non ottimali (4).
Nonostante, come detto, questo particolare settore delle infezioni osteoarticolari abbia goduto gli effetti di un grande interesse e siano cresciuti gli studi che hanno consentito di giungere alla formulazione di linee guida di diagnosi e trattamento largamente note e sostanzialmente condivise dalla maggioranza dei centri, non poche sono le zone d’ombra in cui ancora persistono questioni irrisolte o controverse. Scorrendo la letteratura dell’anno trascorso ci si imbatte in alcune interessanti pubblicazioni, principalmente relative agli aspetti diagnostici ed alle strategie di approccio al trattamento delle PJI, che val la pena di commentare.
La diagnosi dell’infezione protesica
Porre diagnosi di infezione protesica non è sempre semplice, specie nel sospetto di infezioni precoci, ovvero intervenute entro le prime 3-4 settimane dall’ intervento .
La letteratura recente ci offre una buona opportunità rappresentata da un’ autorevole messa a punto sugli aspetti diagnostici operata dalla American Academy of Orthopaedic Surgeons (AAOS) che ha pubblicato nel Giugno 2010 le sue linee guida sulla diagnosi delle PJI (14). Queste ponderose linee guida consentono di focalizzare alcuni aspetti quali la forte indicazione ad eseguire una artrocentesi nell’iter diagnostico di una sospetta PJI. Il campione andrebbe raccolto dopo almeno 2 settimane di sospensione della terapia antibiotica ed inviato, oltre che per gli esami colturali, anche per la conta dei globuli bianchi. Questa pratica, spesso enunciata ma raramente messa in pratica, appare utilissima per una corretta diagnosi. A tal proposito appare convergente il parere espresso dalle recenti linee guida francesi che identificano in 1700 cell/mmc il limite di cellule oltre cui la probabilità di infezione appare molto significativo (sensibilità 94%, specificità 88%). Analogamente una percentuale di granulociti superiore al 65% appare fortemente suggestivo per PJI (15). Sempre incerto appare il ruolo delle indagini scintigrafiche che comunque non dovrebbero essere ritenute affidabili entro i primi 6 mesi dall’intervento.
Tutta la letteratura, più o meno recente, concorda naturalmente sull’importanza di compiere ogni sforzo possibile per ottenere una precisa diagnosi eziologica. Questo della più precisa definizione eziologica è un altro punto estremamente delicato. E’ noto come in una parte non trascurabile di PJI non sia possibile l’isolamento del germe responsabile. Un recente lavoro del gruppo della Mayo Clinic ha confermato le osservazioni di studi precedenti che evidenziavano come l’impiego di antibiotici prima dell’esecuzione degli esami colturali sia la principale causa del mancato isolamento dell’agente eziologico (11,12). Gli autori, benchè lo studio non dimostri differenze nel risultato del trattamento tra casi con e senza isolamento, rilevano come i casi coltura-negativi tendano ad essere trattati in maniera più aggressiva.
I tentativi di migliorare l’accuratezza diagnostica hanno visto, negli ultimi anni concentrarsi gli sforzi in particolare sulla rivisitazione di una metodica ben nota ai microbiologi: la sonicazione. Questo trattamento fisico, applicato per la prima volta agli impianti protesici da Tramputz (12) consente di aumentare la sensibilità delle indagini colturali anche in caso di precedente trattamento antibiotico (13). La sonicazione si è imposta pertanto come procedura routinearia in molti centri clinici che si occupano di PJI, consentendo generalmente un miglioramento della sensibilità diagnostica. Non possono essere tuttavia sottaciuti gli svantaggi costituiti da costi, tempo necessario, difficoltà organizzative (specie in caso di impianti protesici di grosse dimensioni), rischi di contaminazioni e la possibilità, in caso di imperfetta esecuzione dell’esame, di uccidere, durante la sonicazione, i batteri eventualmente presenti sulla superficie del materiale. Alcuni gruppi si stanno quindi impegnando per trovare vie alternative a tale pratica. Tra le prospettive che potrebbero apparire più promettenti, per la semplicità d’uso e i bassi costi, vi è l’impiego di acido ialuronico.
Le possibilità di trattamento dell’infezione protesica sono riconducibili a 5 differenti tipologie:
- Sostituzione protesica in un tempo + antibioticoterapia
- Sostituzione protesica in due tempi + antibioticoterapia
- Debridment chirurgico senza rimozione dell’impianto + antibioticoterapia soppressiva
- Rimozione senza reimpianto
- Amputazione
Poichè sui punti 1,4 e 5 non vi sono sostanzialmente pubblicazioni recenti di un qualche interesse ci concentreremo essenzialmente su alcuni aspetti relativi alla revisione in due tempi e al trattamento conservativo.
Il trattamento two stage
E’ ormai riconosciuto dalla grande maggioranza degli autori, che il trattamento di revisione e reimpianto in due tempi deve essere considerato il gold standard nella terapia della maggior parte delle infezioni protesiche. Numerose pubblicazioni riportano percentuali di guarigione di 80-90% (6-7-8) con questa metodica, che comporta la rimozione della protesi, il posizionamento, facoltativo, di uno spaziatore in cemento, un trattamento antibiotico di circa 6-8 settimane e quindi il posizionamento di una nuova protesi.
Nonostante lo schema riportato trovi, come detto, generale consenso, non mancano alcuni punti mal definiti o su cui le certezze sono ancora poche. In particolare il modo stesso in cui valutare l’esito del trattamento si presta, come vedremo, a non pochi equivoci. Persistono inoltre incertezze sulla durata del trattamento antibiotico, sulle modalità, sui tempi ideali del reimpianto, sulle modalità con cui eseguirlo.
Per quanto riguarda la valutazione dei risultati vorrei citare due recenti lavori. Betsch e colleghi riportano una percentuale di guarigioni, nella loro casistica trattata in stretto accordo con le linee guida proposte da Zimmerli, del 57% (9). Il gruppo inglese di Oxford ha pubblicato nel 2010 un bello studio su 152 casi di PJI trattati con revisione in due tempi con un cure rate di 83% (10). In entrambi i casi ciò che più condiziona la percentuale di successi pare essere la complessità della casistica trattata. Centri di riferimento tendono spesso ad includere nelle loro casistiche pazienti più complessi dal punto di vista chirurgico, più compromessi dal punti di vista generale o con infezioni da microrganismi a prognosi più sfavorevole. In particolare analizzando lo studio inglese la percentuale di pazienti guariti sale al 89% se si analizzano separatamente le infezioni occorse in protesi primarie; la stessa percentuale scende al 73% se si analizzano separatamente i pazienti con precedenti interventi di revisione.
La durata del trattamento antibiotico
Un punto focale ancora solo parzialmente risolto è costituito dall’identificazione della durata ottimale del trattamento antibiotico. La maggior parte dei clinici adotta terapie di durata variabile tra 6 e 8 settimane. Due studi pubblicati nel 2009 hanno dimostrato, in verità in casistiche non sufficientemente ampie, una buona efficacia di trattamenti di, rispettivamente, una e due settimane. (16, 17). L’ipotesi è affascinante ed è probabile che vi siano tipologie di pazienti per i quali questi trattamenti possono essere sufficienti. Tuttavia allo stato attuale non mi pare esistano dati sufficienti per consentire di utilizzare questi schemi brevi in maniera estesa. Al contrario appare meglio definita la durata massima di trattamento. Appare infatti inutile prolungarlo oltre le 6-8 settimane (18).
Il reimpianto
Quella del reimpianto è, tra le varie fasi del trattamento two stage, quella in cui i dati della letteratura sono più vaghi e fumosi. Scorrendoli si ha a tratti l’impressione che il reimpianto sia, anziché parte integrante dello schema terpeutico, come è mia profonda convinzione, un tempo successivo e distinto dalla terapia che si verifica, con modalità assai difformi tra i vari centri, ad infezione risolta.
I tempi del reimpianto, naturalmente legati anche alla durata dello schema antibiotico utilizzato, le valutazioni cliniche che lo precedono, le modalità con cui lo si esegue e il follow up successivo sono tutti punti essenziali per una buona riuscita del trattamento. Le recenti linee guida francesi identificano due differenti schemi ammessi nel trattamento in due tempi e da questi potremmo iniziare la nostra analisi.
|
2 short steps |
2 long steps |
|
Intervallo tra rimozione e reimpianto 4-6 settimane |
Intervallo tra rimozione e reimpianto 3-6 mesi |
|
|
I due schemi riportati rispondono a due differenti necessità. Da un lato la sicurezza di reimpiantare in condizioni di assenza di infezione. Tale necessità appare probabilmente meglio soddisfatta dalla seconda modalità. D’altro canto è noto come intervalli di durata superiore ai 3 mesi comportino un più elevato rischio di complicazioni meccaniche. Ciò spiega i tentativi di ridurre l’intervallo tra i due tempi chirurgici.
La durata è solo uno degli aspetti. Forse ancor più importante identificare correttamente quali pazienti possono essere reimpiantati e la modalità con cui farlo. Il nostro gruppo segue uno schema assai collaudato che ha mostrato di dare buoni risultati.
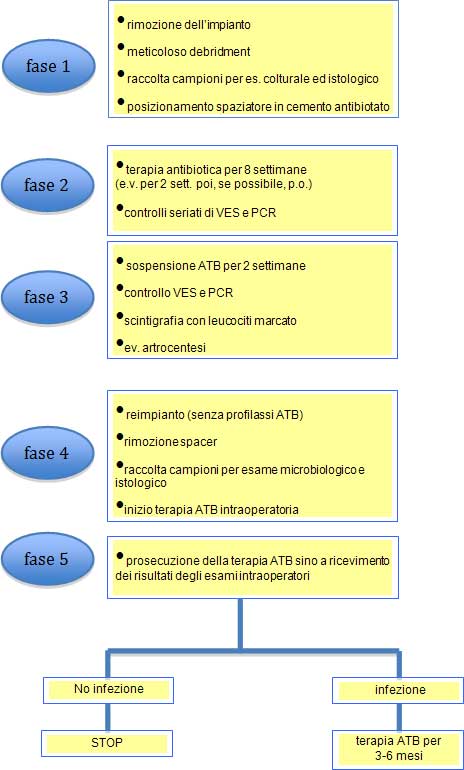
Questo schema è molto vicino a quello lungo delle linee guida Francesi, benchè, nella pratica, si tenda a reimpiantare i pazienti entro 3-4 mesi dall’espianto.
Nonostante i buoni risultati ottenuti (guarigione nel 93% dei pazienti reimpiantati) alcuni punti sono oggetto di discussione.
Oltre alla già citata durata, sulla quale non vi sono, allo stato attuale, elementi sufficientemente forti per operare delle sostanziali modifiche, i punti più controversi sono la modalità di valutazione dei pazienti a termine terapia e l’esecuzione o meno di una profilassi antibiotica al momento del reimpianto (naturalmente quest’ultimo problema non si pone a chi scegliesse di eseguire il reimpianto senza interrompere la terapia antibiotica).
Nessun singolo esame eseguito può fornire dati certi sulla effettiva risoluzione del processo infettivo. Se infatti gli indici di infiammazione ematici (PCR per prima) trovano conferma alla loro utilità anche in dati di letteratura molto recenti, è noto che il loro significato può essere aspecifico e che spesso risultano alterati a causa di processi di altra natura. In particolare la persistenza di alterazioni di questi indici non pare possa, da sola, costituire un impedimento al reimpianto (24,25,26.
Ancor più controverso è il ruolo degli esami scintigrafici. Il loro impiego appare facoltativo e molto legato alla loro interpretazione nel contesto globale del paziente (14). Certamente la scintigrafia con leucociti marcati autologhi, che rappresenta il gold standard in questo tipo di patologia, presenta una percentuale di falsi positivi assai elevata nei sei mesi che seguono un intervento chirurgico e ciò male si concilia con la sopra detta necessità di accorciare i tempi del reimpianto.
Riguardo alla scelta di non somministrare una profilassi antibiotica al momento del reimpianto essa è stata a lungo discussa ed è effettivamente discutible. Tale procedura è comunque suffragata da letteratura autorevole, pur se non numerosa. Il lavoro più recente reperibile in letteratura riporta l’esperienza della Bone Infection Unit di Oxford. Gli autori descrivono una popolazione di pazienti assai numerosa trattata con un protocollo estremamente simile a quello sopra descritto. La conclusione, in pieno accordo con la nostra esperienza, è che l’esecuzione di esami microbiologici al momento del reimpianto, ancorchè approvata dalle linee guida, non pare poter predire efficacemente la prognosi finale e può esporre al rischio di overtreatment dei pazienti. Tuttavia sia nella esperienza inglese che nella nostra non si è osservato un aumento di nuove infezioni legate a tale procedura e i risultati finali sono, in entrambi i casi, assai buoni.
Una possibilità ulteriore per evidenziare una eventuale infezione residua è il ricorso all’esame istologico che consente di valutare la presenza di leucociti e di aspetti istologici tipici dell’infezione. Noi utilizziamo da anni la classificazione di Morawietz per classificare prelievi istologici effettuati sia in caso di espianto di protesi, sia al momento del reimpianto (19). Tuttavia l’interpretazione del dato istologico non è sempre facile e comunque il risultato è disponibile solo alcuni giorni dopo. Molti clinici considerano più utile eseguire, durante l’intervento di reimpianto, un esame istologico estemporaneo su materiale congelato, metodica largamente utilizzata nella chirurgia neoplastica, Tale procedura, recentemente descritta dallo stesso gruppo tedesco, è stata messa a punto per essere utilizzata al momento di espiantare protesi mobilizzate la cui natura non settica possa essere dubbia (praticamente tutte le mobilizzazioni). Per questo impiego essa è fortemente raccomandata dalle già citate linee guida AAOS. Non esistono, a mia conoscenza lavori che ne descrivano l’impiego al momento del reimpianto, ma tale pratica è ormai abbastanza diffusa non essendoci particolari motivi per metterne in dubbio l’utilità anche in tale circostanza (14-20). Tuttavia non possono essere sottaciuti alcuni problemi irrisolti quali la mancanza di un cut-off certo oltre cui definire l’infezione (numero di leucociti per campo), l’estrema dipendenza dall’operatore, le difficoltà organizzative e il sensibile allungamento dei tempi operatori.
Terapia conservativa
Le possibilità di guarire una infezione protesica sono decisamente inferiori se si scelga di mantenere in sede l’impianto. E’ piuttosto difficile, ed a mio avviso anche inutile, tentare di fornire un dato globale sulla percentuale di successo delle terapie conservative per la grande eterogeneicità delle popolazioni comprese nei differenti studi presenti in letteratura. Sostanzialmente la decisione di mantenere una protesi infetta in sede può essere ricondotta a due condizioni fondamentali: una scelta o un obbligo.
C’è un generale accordo sul fatto che un trattamento conservativo trovi indicazione primaria unicamente in caso di infezione recente. Tale condizione può essere ricondotta ad una infezione insorta acutamente a poca distanza dall’impianto (generalmente entro 3-4 settimane) o ad una infezione tardiva ematogena insorta acutamente in un paziente con impianto protesico stabile. In entrambi i casi la probabilità di successo è fortemente condizionata dalla precocità con cui viene eseguito un debridment chirurgico (eventualmente con sostituzione di alcuni componenti dell’impianto), e della possibilità di utilizzare trattamenti prolungati rifampicina-based.
L’altra possibilità di impiego delle strategie conservative è rappresentata dal trattamento conservativo offerto a pazienti che non possono rimuovere l’impianto. Tale impossibilità può essere determinata dall’età, dall’eccessivo rischio operatorio, da difficoltà tecniche legate alla natura ed al tipo di impianto e dalla valutazione della qualità dell’osso e della possibile funzionalità residua dopo l’intervento. Si tratta in buona sostanza, nella grande maggioranza dei casi, non di una scelta ma di una decisione obbligata, volta a tentare di mantenere un accettabile controllo dell’infezione e a garantire al paziente una accettabile funzionalità. Su questa tipologia di trattamento, probabilmente quella più frequentemente adottata nella pratica quotidiana, i dati in letteratura sono praticamente nulli e i risultati, in termini di guarigione microbiologica, generalmente pessimi.
Le uniche indicazioni primarie al trattamento conservativo restano quindi l’infezione precoce e l’infezione tardiva ematogena insorta di recente. Su queste vi è consenso sulle più recenti linee guida (1,5,15). Svariate ricerche, nel corso degli anni, hanno fornito elementi a favore di tale impostazione. In particolare lo studio di Zimmerli del 1998 che, in quello che forse resta a tutt’oggi l’unico studio randomizzato sulle infezioni ortopediche, dimostrava come in pazienti, affetti da PJI da stafilococco, trattati con debridment precoce e terapia soppressiva avessero una percentuale di guarigione del 100% quando trattati con associazione di rifampicina e fluorochinolonico. I risultati eccellenti di questo studio sono forse legati in parte alla stretta selezione dei pazienti, al loro numero piuttosto esiguo ed alle particolarità microbiologiche di questa popolazione in cui era praticamente sconosciuta la meticillino resistenza. Tutti gli altri studi presenti in letteratura presentano dati molto discordanti, con percentuali di successo che variano tra 50 e 80 % (21,22).
Un recente studio del gruppo di J.Parvizi ha dimostrato una percentuale di successo di solo 44% (decisamente molto meno incoraggiante rispetto ad altri studi). In generale i risultati appaiono tanto migliori quanto più si seleziona la popolazione trattata. Mi pare pertanto pienamente condivisibile la conclusione degli autori che ritengono che la terapia conservativa, trovi indicazione solo dopo una attenta selezione dei pazienti (23).
Per concludere, le già citate linee guida francesi danno l’indicazione al trattamento conservativo con un livello di forza della raccomandazione piuttosto basso e ciò a ragione delle incertezze e delle disparità che provengono dai dati della letteratura sopra ricordati.
Personalmente ritengo che l’enfasi posta su tale metodica negli ultimi anni potrebbe essere stata eccessiva per due ordini di ragioni. La prima è una ragione teorica; se l’infezione protesica si verifica principalmente all’interfaccia protesi/osso quale può essere l’influenza di un debridment artrotomico che necessariamente non interessa questa fondamentale area? Inoltre dal punto di vista pratico sono da considerare accettabili percentuali di guarigione mediamente intorno a 75-80% in condizioni cliniche che potrebbero essere ideali per ottenere, con un intervento di sostituzione protesica, risultati potenzialmente ben migliori? Non vi sono, a mia conoscenza, studi che valutino trattamenti di revisione one o two stages in pazienti con infezione precoce ma non mi stupirei se i risultati ottenuti da chi si cimentasse in tale trattamento fossero notevolmente migliori di quelli ottenibili con strategie di debridment and retention-
Terminando questa breve rassegna così concentrata sui dubbi e sui punti oggetto di discussione mi rendo conto di correre il rischio di ingenerare una sorta di scoramento derivante dalla sensazione che non esistano punti fermi e riferimenti sicuri. Ciò sarebbe ingeneroso e scorretto. La letteratura più recente è, effettivamente, in parte concentrata a rivalutare criticamente alcune zone d’ombra, ma ciò non può oscurare i progressi fatti nell’ultimo decennio, durante il quale si sono stabiliti criteri certi e largamente condivisi nel trattamento.
Il problema attuale è, casomai, far si che i principi generali del trattamento siano applicati e condivisi universalmente e non solo a livello di alcuni centri specializzati. L’importanza di ciò mi pare ben dimostrata dal recentissimo studio di Belinda Betsch e collaboratori che dimostra come l’applicazione nella pratica quotidiana delle linee guida si sia dimostrata in grado di produrre risultati migliori rispetto a quelli ottenuti quando il medico operava al di fuori di queste (23). Una strategia, seppure imperfetta, èare garantire comunque risulati migliori rispetto a nessuna strategia.
Bibliografia
- S. Leone, S. Borrè and GISIG Working Group on Prosthetic Joint Infections “Consensus document on controversial issue in the diagnosis and tretament of prosthetic joint infections” Int.J.Infect.Dis. 2010;14S4:567-77
- M.A. Cataldo, N. Petrosillo, M. Cipriani, R. Cauda, E. TacconelliS. “Prosthetic joint infection: recent developments in diagnosis and management” J. Infect. 2010; 61:443-8
- S. Kurtz, Ong K, F. Mowat, M. Halpem “Projection of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030” J.Bone Joint. Surg.Am. 2007;89(4):780-5
- T.P. Schulco “The economic impact of infected joint arthroplasty” Orthopaedics 1995;18(9):871-3
- Zimmerli W, Trampuz A, Ochsner PE. “Prosthetic-joint infections” N Engl J Med. 2004 Oct 14;351(16):1645-54
- Giulieri SG, Graber P, Ochsner PE, Zimmerli W. “Management of infection associated with total hip arthroplasty according to a treatment algorithm”. Infection 2004; 32:222–8
- Laffer RR, Graber P, Ochsner E, Zimmerli W. “Outcome of prosthetic knee-associated infection: evaluation of 40 consecutive episodes at a single centre” Clin Microbiol Infect 2006; 12:433–9.
- Berbari EF, Hanssen AD, Duffy MC, et al. “Risk factors for prosthetic joint infection: case-control study”. Clin Infect Dis 1998; 27:1247–54.
- Belinda Y. Betsch, Stefan Eggli, Klaus A. Siebenrock, Martin G. Tauber, and Kathrin Muhlemann “Outcome of Joint Prosthesis Infection” CID 2008:46 (15 April): 1221-6
- P. Bejon, A. Berendt, B. L. Atkins, N. Green, H. Parry, S. Masters, P. Mclardy-Smith, R. Gundle and I. Byren “Two-stage revision for prosthetic joint infection: predictors of outcome and the role of reimplantation microbiology” J Antimicrob Chemother 2010; 65: 569–575
- Davud Malekzadeh, Douglas R. Osmon MD, MPH, Brian D. Lahr MS, Arlen D. Hanssen MD, Elie F. Berbari MD “Prior Use of Antimicrobial Therapy is a Risk Factor for Culture-negative Prosthetic Joint Infection” Clin Orthop Relat Res (2010) 468:2039–2045
- Trampuz A, Piper KE, Jacobson MJ, Hanssen AD, Unni KK, Osmon DR, Mandrekar JN, Cockerill FR, Steckelberg JM, Greenleaf JF, Patel R. “Sonication of removed hip and knee pros- theses for diagnosis of infection”. N Engl J Med. 2007;357:654–663.
- Johannes Holinka, Leonhard Bauer, Alexander M. Hirschl, Wolfgang Graninger, Reinhard Windhager, Elisabeth Presterl “Sonication Cultures of Explanted Components as an Add-On Test to Routinely Conducted Microbiological Diagnostics Improve Pathogen Detection” J. ORTHOPAEDIC RES.
- AAOS Clinical Practice Guidelines Unit “The diagnosis of priprosthetic joint infections of the hip and knee”
- AA. VV. “Recommendations for bone and joint prosthetic device infections in clinical practice” Médecine et maladies infectieuses xxx (2010) 185–211
- P.H. Hsich, K. Huang, P.C Lee, M.S. Lee “Two stage revision of infected hip arthroplasty using an antibiotic-loaded spacer: retrospective comparison between short-term and prolonged antibiotic therapy” J. Antimicrob. Chemoter. 2009;64:392-7
- J. P. Whittaker, R. E. Warren, R. S. Jones, P. A. Gregson “Is prolonged systemic antibiotic treatment essential in two-stage revision hip replacement for chronic Gram-positive infection?” J. Bone. Joint Surg 2009; 91-B, No. 1: 44-51
- Louis Bernard, Laurence Legout, Line Zurcher-Pfund, Richard Stern, Peter Rohner , Robin Peter , Mathieu Assal , Daniel Lew , Pierre Hoffmeyer , Ilker Uckay “Six weeks of antibiotic treatment is sufficient following surgery for septic arthroplasty” Journal of Infection (2010) 61: 125-32
- L. Morawietz, R-A Classen, J.H. Schroder, C. Dynybil, C. Perka, A. Skwara, J. Neidel, T. Gehrke, L. Frommelt, T. Hansen, M. Otto, B. Barden, T. Aigner, P. Stiehl, T. Schubert, C. Bos, C. Hendrich, J. Kriegsmann, V. Krenn “Proposal for a histopatological consensus classification of the periprosthetic interface membrane” J. Clin. Pathol. 2006; 59:591-7
- Stephan W. Tohtz MD, Michael Muller MD, Lars Morawietz MD, Tobias Winkler MD, PhD, Carsten Perka MD “Validity of Frozen Sections for Analysis of Periprosthetic Loosening Membranes” Clin Orthop Relat Res (2010) 468:762–8
- E. Moran, I. Byren and B. L. Atkins “The diagnosis and management of prosthetic joint infections” J Antimicrob Chemother 2010; 65 Suppl 3: iii45–54
- I. Byren, P. Bejon, B. L. Atkins, B. Angus, S. Masters, P. McLardy-Smith, R. Gundle and A. Berendt “One hundred and twelve infected arthroplasties treated with ‘DAIR’ (debridement, antibiotics and implant retention): antibiotic duration and outcome” Journal of Antimicrobial Chemotherapy (2009) 63, 1264–1271
- Belinda Y. Betsch, Stefan Eggli, Klaus A. Siebenrock, Martin G. Täuber, and Kathrin Muhlemann “Treatment of Joint Prosthesis Infection in Accordance with Current Recommendations Improves Outcome” CID 2008:46 (15 April):1221-6
- Sharat K. Kusuma MD, MBA, Joseph Ward BA, Marc Jacofsky PhD, Scott M. Sporer MD, Craig J. Della Valle MD “What is the Role of Serological Testing Between Stages of Two-stage Reconstruction of the Infected Prosthetic Knee?” SYMPOSIUM: PERIPROSTHETIC JOINT INFECTION Cl. Orthop. Rel. Res. DOI 10.1007/s11999-010-1619-7
- R. J. Piso , R. Elke “Antibiotic treatment can be safely stopped in asymptomatic patients with prosthetic joint infections despite persistent elevated C-reactive protein values” Infection (2010) 38:293–296
- C. Ruef “Prosthetic joint infections: what to do if the C-reactive protein level remains elevated” Infection (2010) 38:247